哈医大二院Adv Sci发表:ChIP-qPCR与CUT&Tag揭示组蛋白乳酸化调控子宫内膜异位症铁死亡抗性的关键机制
发布时间:
2025-09-25
子宫内膜异位症(EMs)手术与药物治疗均受限于高复发率与副作用。近年研究发现,异位内膜间质细胞(EESCs)存在铁死亡抗性,但其分子机制尚未明确。
哈尔滨医科大学附属第二医院张宗峰唯一通讯发表的这篇文章,运用ChIP-qPCR、CUT&Tag、Western blot、免疫荧光等表观技术,首次揭示组蛋白乳酸化通过 METTL3调控的HIF1A/HMOX1信号通路介导EESCs铁死亡抗性,且2-脱氧-D-葡萄糖(2-DG)与铁死亡诱导剂erastin联合治疗可显著抑制异位病灶。这一发现为 EMs 发病机制提供新视角,更开辟了精准治疗新路径
标题:Elevated Histone Lactylation Mediates Ferroptosis Resistance in Endometriosis Through the METTL3-Regulated HIF1A/HMOX1 Signaling Pathway.
译名:组蛋白乳酸化水平升高通过 METTL3 调控的 HIF1A/HMOX1 信号通路介导子宫内膜异位症中的铁死亡抗性
期刊:Advanced science
影响因子:IF=14.1
发表时间:2025.6.10
通讯作者: Zongfeng Zhang
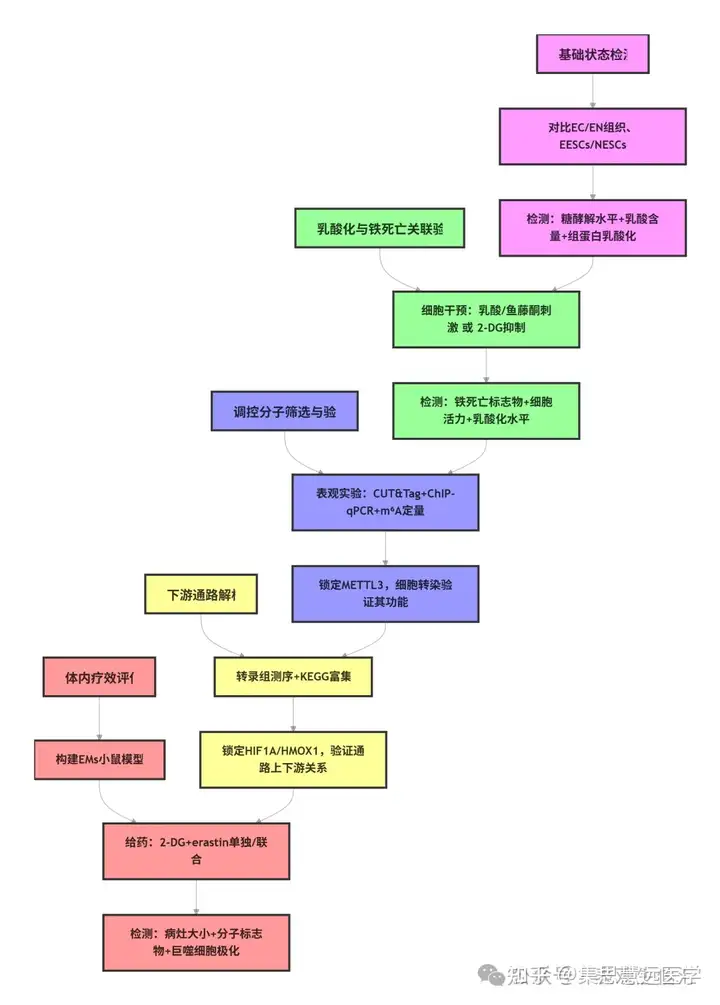
研究思路
核心研究结果
- 异位内膜间质细胞(EESCs)中糖酵解水平升高导致乳酸积累,使整体组蛋白乳酸化及 H3K18la 水平显著上调,且乳酸化蛋白定位于细胞核。
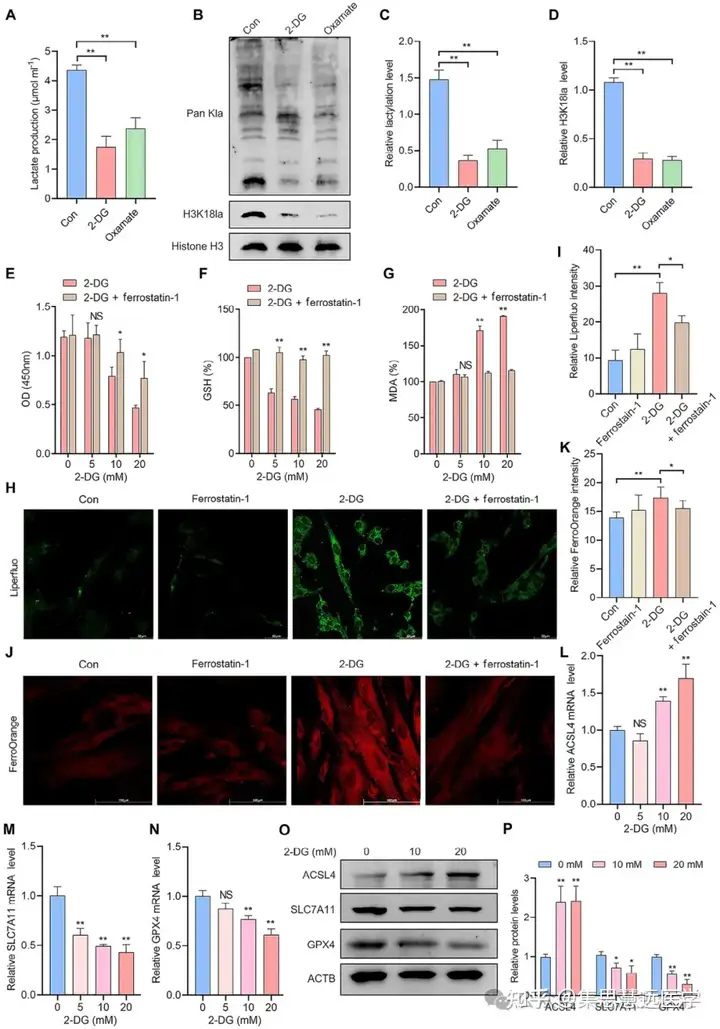
- 组蛋白乳酸化可增强 EESCs 对铁死亡的抗性,糖酵解抑制剂降低乳酸化后则提升铁死亡敏感性,铁死亡抑制剂可部分逆转该效应。
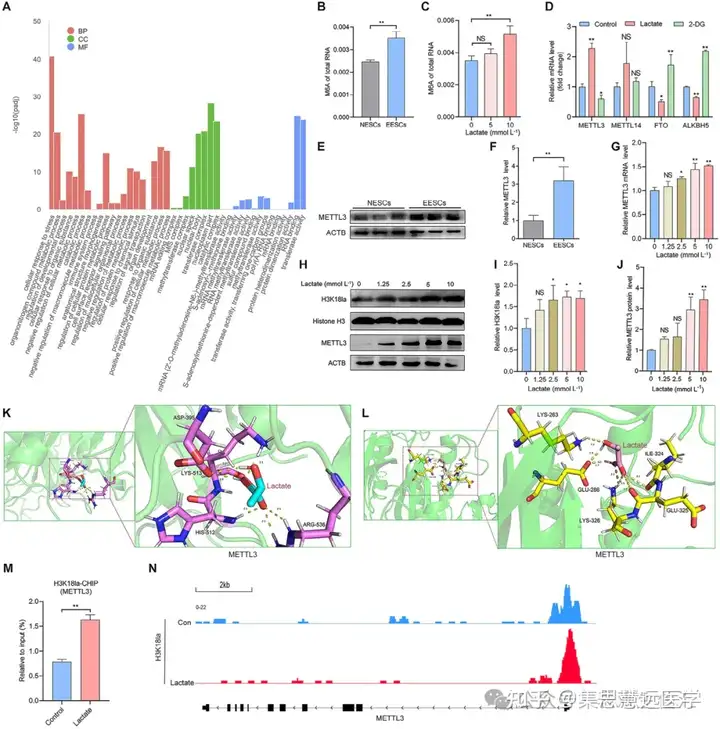
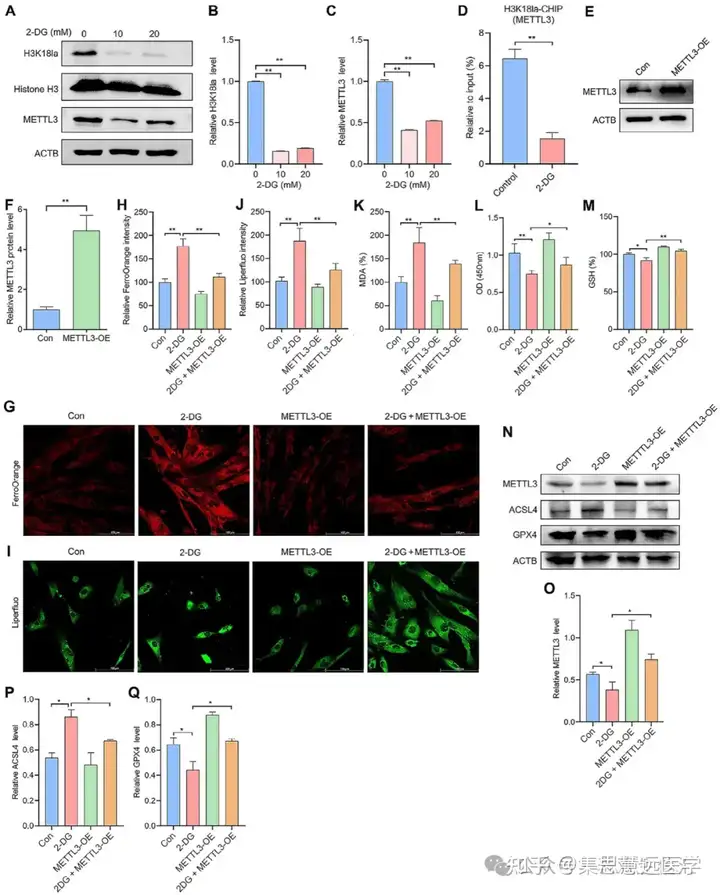
- 组蛋白乳酸化通过富集于 METTL3 启动子区调控其表达,METTL3 介导组蛋白乳酸化对 EESCs 铁死亡的调控作用。
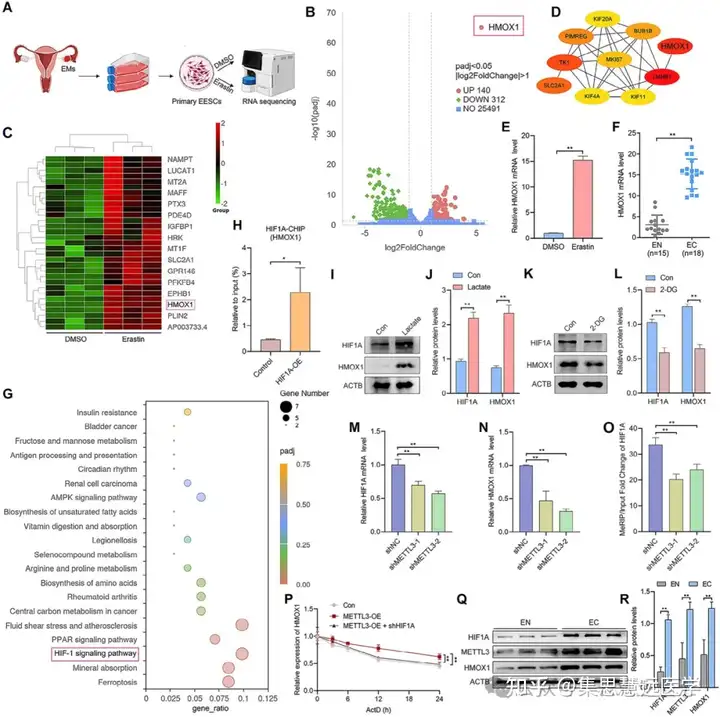
- HIF1A/HMOX1 是 METTL3 介导 EESCs 铁死亡抗性的关键通路,METTL3 通过调控该通路发挥作用。
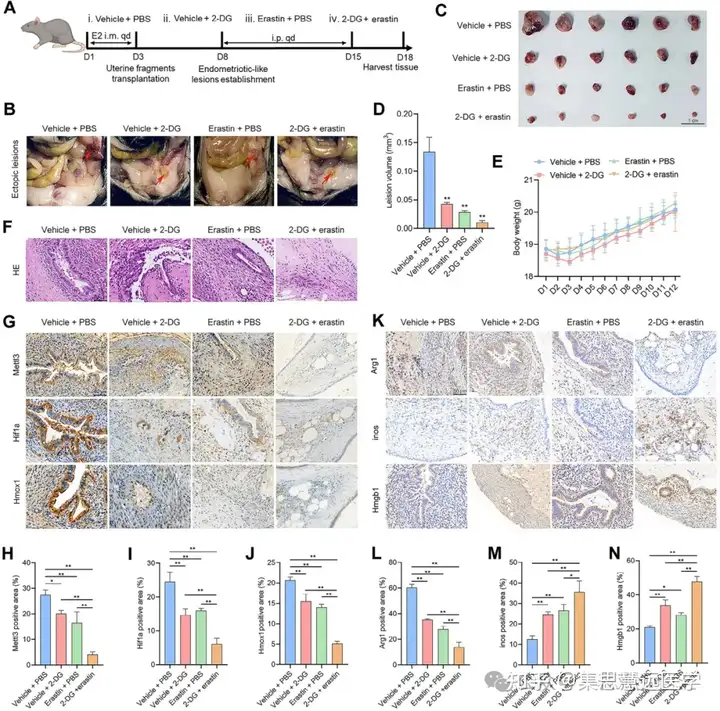
- 2 - 脱氧 - D - 葡萄糖(2-DG)与erastin联合治疗可显著缩小EMs小鼠异位病灶,下调相关蛋白表达并调控巨噬细胞极化。
文章主要内容
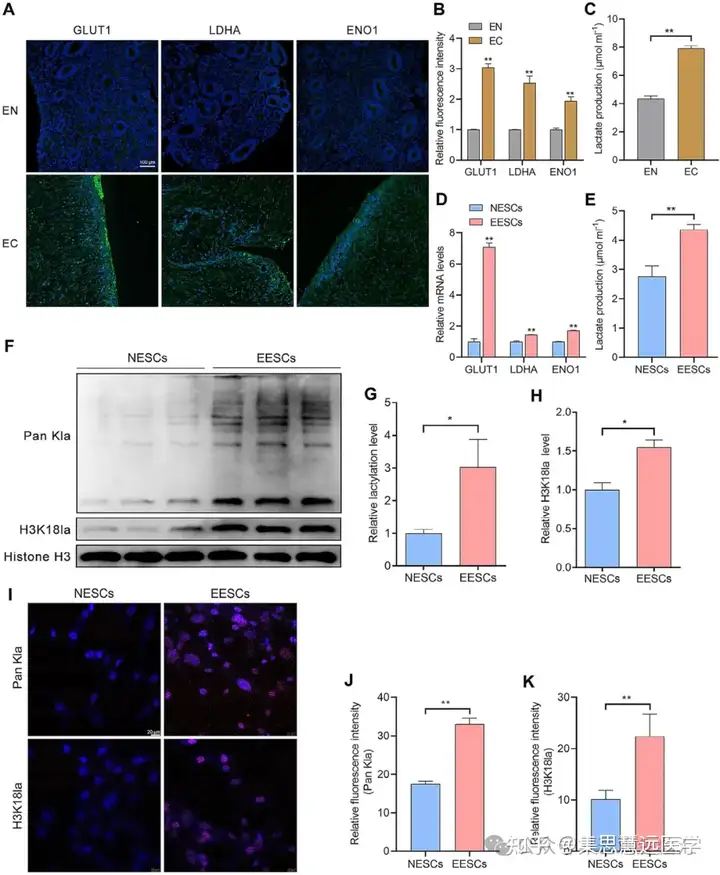
明确 EESCs 中组蛋白乳酸化状态:为探究组蛋白乳酸化与 EMs 的关联,通过免疫荧光、qRT-PCR、Western blot 等检测组织与细胞指标。结果显示 EC 组织糖酵解活性与乳酸含量升高,EESCs 整体组蛋白乳酸化及 H3K18la 水平显著高于 NESCs(图 1D-K)。
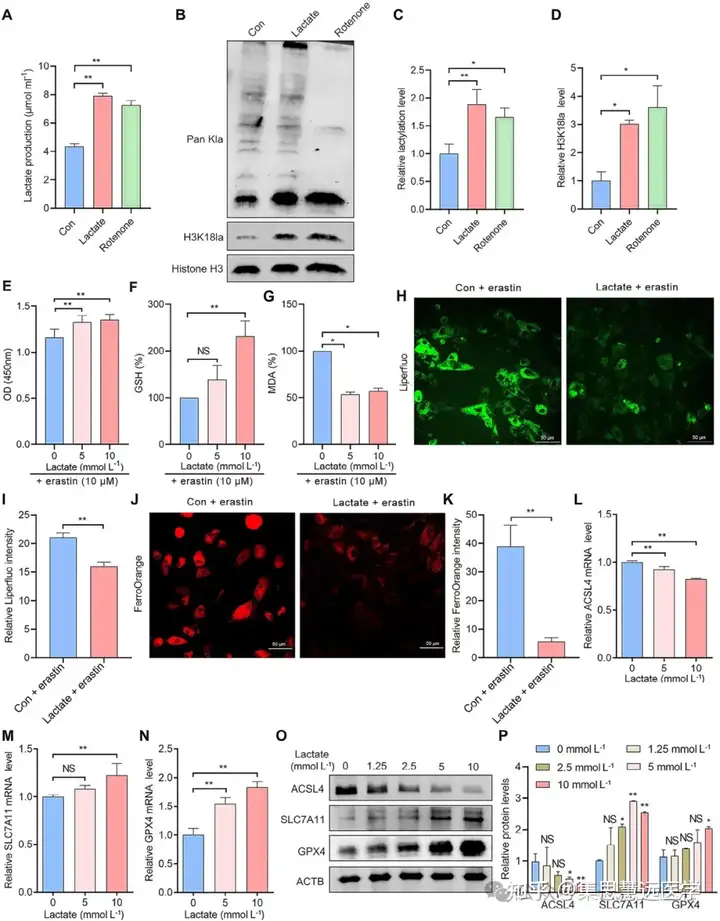
探究组蛋白乳酸化对铁死亡的影响:为验证乳酸化与铁死亡抗性的关系,用乳酸/鱼藤酮或糖酵解抑制剂干预 EESCs,检测细胞活力、铁死亡标志物等。结果显示乳酸化升高增强铁死亡抗性,降低则提升敏感性,铁死亡抑制剂可部分逆转(图 2E-P、3E-K)。
解析组蛋白乳酸化的调控分子:为找到乳酸化调控的关键基因,通过 CUT&Tag、m⁶A 定量、细胞转染等实验。结果显示 H3K18la 靶向 METTL3,其在 EESCs 中高表达,过表达 METTL3 可逆转糖酵解抑制剂诱导的铁死亡(图 4M-N、5G-L)。
锁定铁死亡抗性的下游通路:为明确 METTL3 调控铁死亡的机制,开展转录组测序、ChIP-qPCR 及细胞转染实验。结果显示 HIF1A/HMOX1 是核心通路,干预 HIF1A 可逆转 METTL3 的效应(图 6H、7A-G、8A-G)。
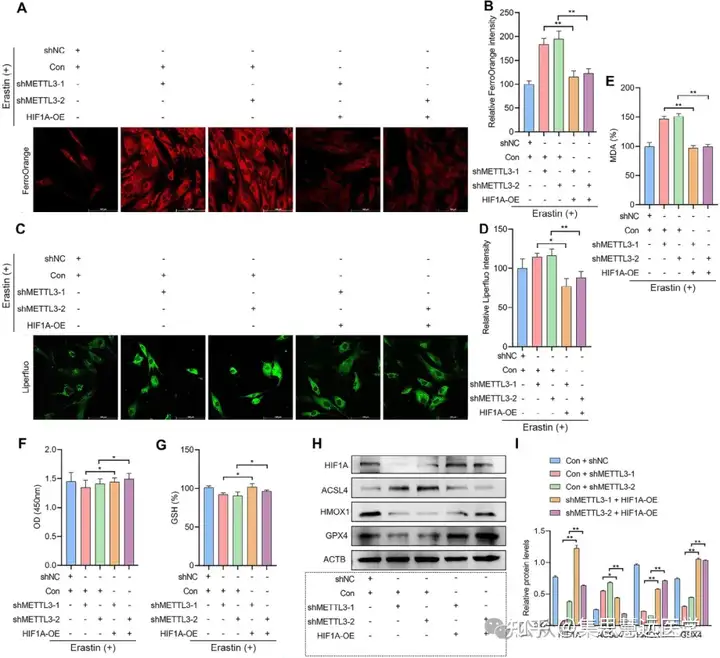
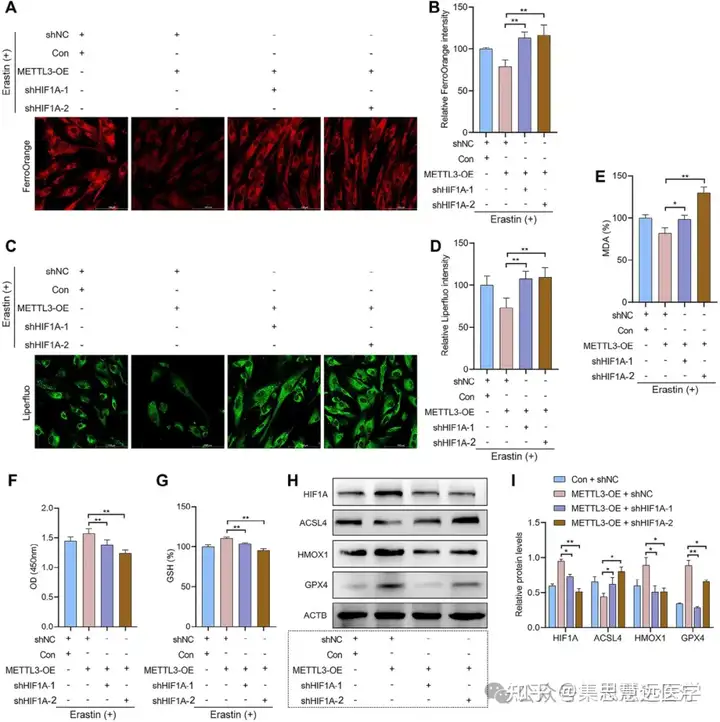
验证联合疗法的体内疗效:为评估治疗效果,在EMs小鼠模型中给药,检测病灶及分子指标。结果显示联合治疗显著缩小病灶,降低相关蛋白表达,调控巨噬细胞极化(图 9B-D、9G-N)。
文章总结
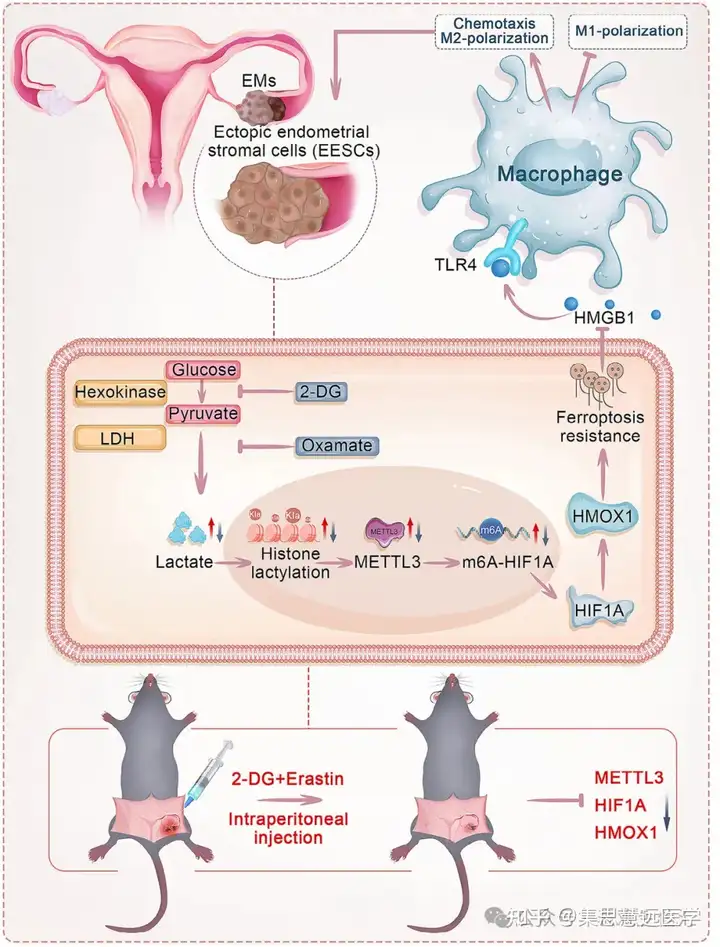
本研究首次阐明组蛋白乳酸化在 EMs 铁死亡抗性中的关键作用,揭示 “组蛋白乳酸化→METTL3 上调→HIF1A/HMOX1 通路激活→铁死亡抗性” 的完整调控链。
其创新点在于将糖酵解代谢产物介导的表观遗传修饰与铁死亡抗性关联,明确 METTL3 作为表观遗传与 RNA 修饰的交叉节点;更证实 2-DG(抑制乳酸化)与 erastin(诱导铁死亡)的联合疗法可通过下调 METTL3-HIF1A/HMOX1 轴、调控巨噬细胞极化抑制病灶。该发现不仅填补 EMs 铁死亡抗性机制空白,更提供了 “抑制乳酸化 + 诱导铁死亡” 的精准治疗策略,为临床转化奠定基础。
相关新闻

微信公众号











