热蛋白组学技术
热蛋白组学技术
关键词:
热蛋白组学技术
产品分类:
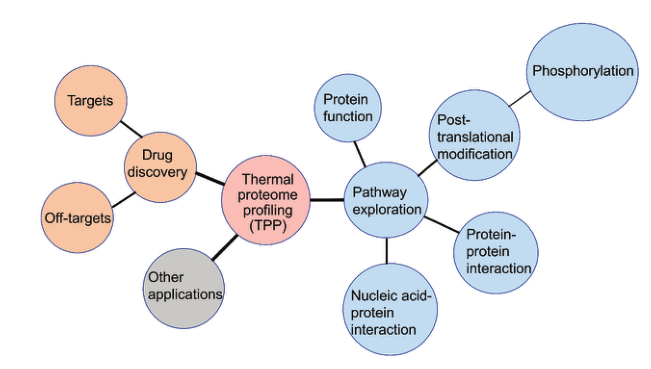
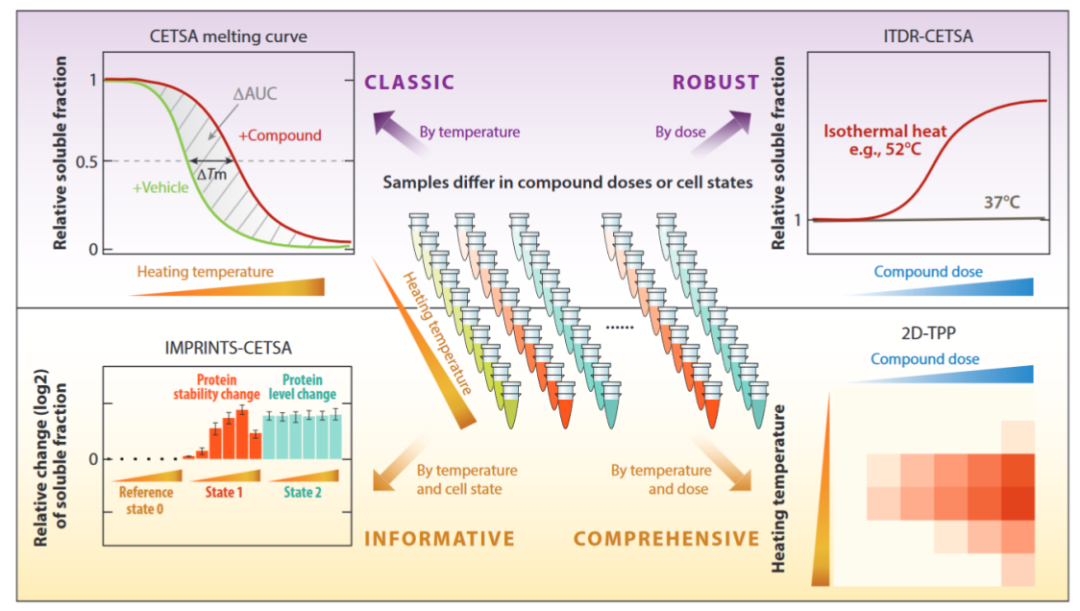
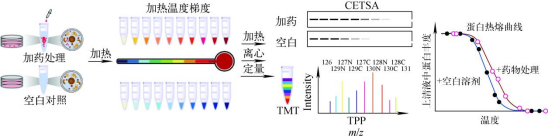
热蛋白质组学分析(Thermal proteome profiling )将化合物和空白对照分别与样本孵育之后,在不同的温度梯度下分别进行加热。经过加热后,孵育体系中仍保持折叠状态的配体结合蛋白相对稳定,而没有结合配体的蛋白会解折叠,从而迅速变性产生沉淀。之后利用免疫印迹或者基于质谱的方法根据其熔解曲线分析可溶性蛋白的热稳定性,从而确证化合物与细胞内蛋白的结合。
- 构效关系复杂或难以改造的小分子
- 小分子结合目的蛋白的一对一验证
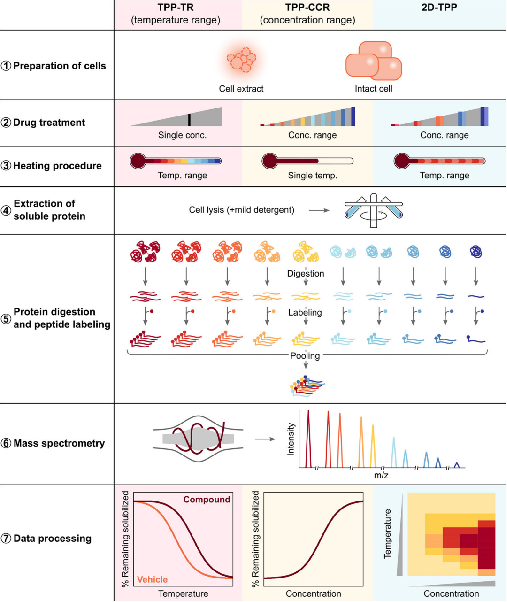
TPP主要包括温度范围的热蛋白质组学分析(TPP temperature range, TPP- TR)、配体浓度范围的热蛋白质组学分析(TPP compound concentration range, TPP-CCR) 和二维热蛋白质组学分析(two-dimensional TPP, 2D-TPP)。广义上说,TPP的方法步骤主要包括:(1) 样品制备;(2) 热处理;(3) 收集可溶性蛋白组分;(4) 基于质谱的蛋白组学分析;(5) 数据分析。其中样品制备包括要研究的细胞材料和条件改变,细胞材料可以是细胞提取物、完整细胞、组织、生物体液(如血液) 和微生物(如古菌、细菌、原生生物、真菌);条件变化通常是化学(如药物或代谢物)、遗传(如基因敲除或过表达)、环境的变化和不同的细胞状态(如细胞周期的不同阶段),也能在无条件变化下研究蛋白质在原位的熔解行为。热处理是对样品进行短暂的热处理以诱导蛋白质变性聚集,时间通常为3 min。可溶性蛋白组分通常通过超速离心收集上清液或使用多孔滤板以低速离心收集。可溶性蛋白提取后用蛋白酶将蛋白质消化成肽,然后一般通过稳定同位素标记试剂串联质量标签(tandem mass tags, TMT) 对不同样本进行标记,通过质谱法对每个样品中肽的丰度进行量化。最后用蛋白质组学数据库处理获得的原始质谱数据以识别和量化测定的蛋白质,TPP数据分析的最终目标是找到在两个或多个条件间热稳定性发生改变的蛋白质,具体的分析方法取决于所进行的TPP类型(TPP-TR、TPP-CCR或2D-TPP)
- 无需对小分子进行改造;
- 识别直接作用靶点,可反映天然状态下的结合情况;
- 小分和目的蛋白结合的快速一对一验证。
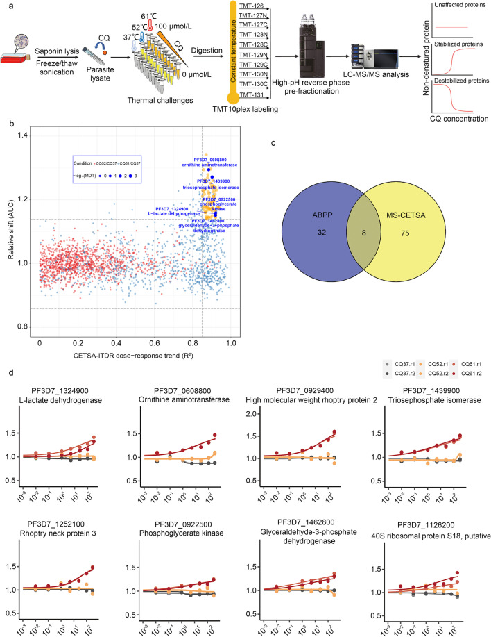
1. Identification of antimalarial targets of chloroquine by a combined deconvolution strategy of ABPP and MS-CETSA. 2022, Military Medical Research, IF = 34.915.
氯喹(Chloroquine, CQ)作为最成功的抗疟药物之一,在世界抗疟进程中发挥了至关重要的作用,然而其具体的抗疟靶点和抗疟机制至今仍充满争议,极大的限制了氯喹在抗疟及其他领域的应用。
本研究采用化学蛋白质组学(ABPP)和细胞热转变分析(CETSA)相结合的研究策略,对CQ的抗疟靶点和作用机制进行了深入研究,发现CQ通过与L-乳酸脱氢酶(LDH),鸟氨酸氨基转移酶(OAT),丙酮酸激酶(Pyrk),磷酸甘油酸激酶(PGK),磷酸丙糖异构酶(TPI)等关键酶直接结合,干扰疟原虫的糖酵解和能量代谢,从而产生抗疟作用。这是首次使用ABPP和MS-CETSA相结合的方法对CQ的抗疟机制进行研究,同时为其他抗疟药物的机制研究提供了新的研究思路。
相关产品
产品留言

微信公众号