斑马鱼实验
斑马鱼实验
关键词:
斑马鱼实验
作为模式动物,斑马鱼的疾病特征、病因和进展以及分子机制与临床相关且高度保守,斑马鱼在发育生物学方面的贡献已得到公认,并已成为人类疾病的一个强有力的临床前模型。在生理相关剂量范围内,斑马鱼对药物分子的反应与人类高度一致,复杂的基因编辑技术加上实时高分辨率成像可以观察到药物分子在斑马鱼疾病模型中前所未有的分子细节。至关重要的是,以斑马鱼为模型的疾病通常代表人类疾病的真实模型,可捕捉疾病的病因、进展和解决过程。以此用来进行活体药物筛选、药理药效评价、安全性评价和药物代谢动力学非常高效且成本低廉。斑马鱼模型在国内外已经被多家大型制药企业广泛使用于早期药物发现。
- 易饲养、繁殖力强、发育快
- 受精卵透明易观察
- 可以对斑马鱼进行精确的基因编辑
- 可以应用于胚胎和成年阶段的人类疾病和药物治疗模型
- 通量高、周期短
- 临床筛选
- 毒性筛选
- 保护性筛选
- 药效评价
- 单体活性评估
- 材料安全性评估
神经类疾病、心脏疾病、心血管疾病、肝脏类疾病、肠道类疾病、免疫类疾病
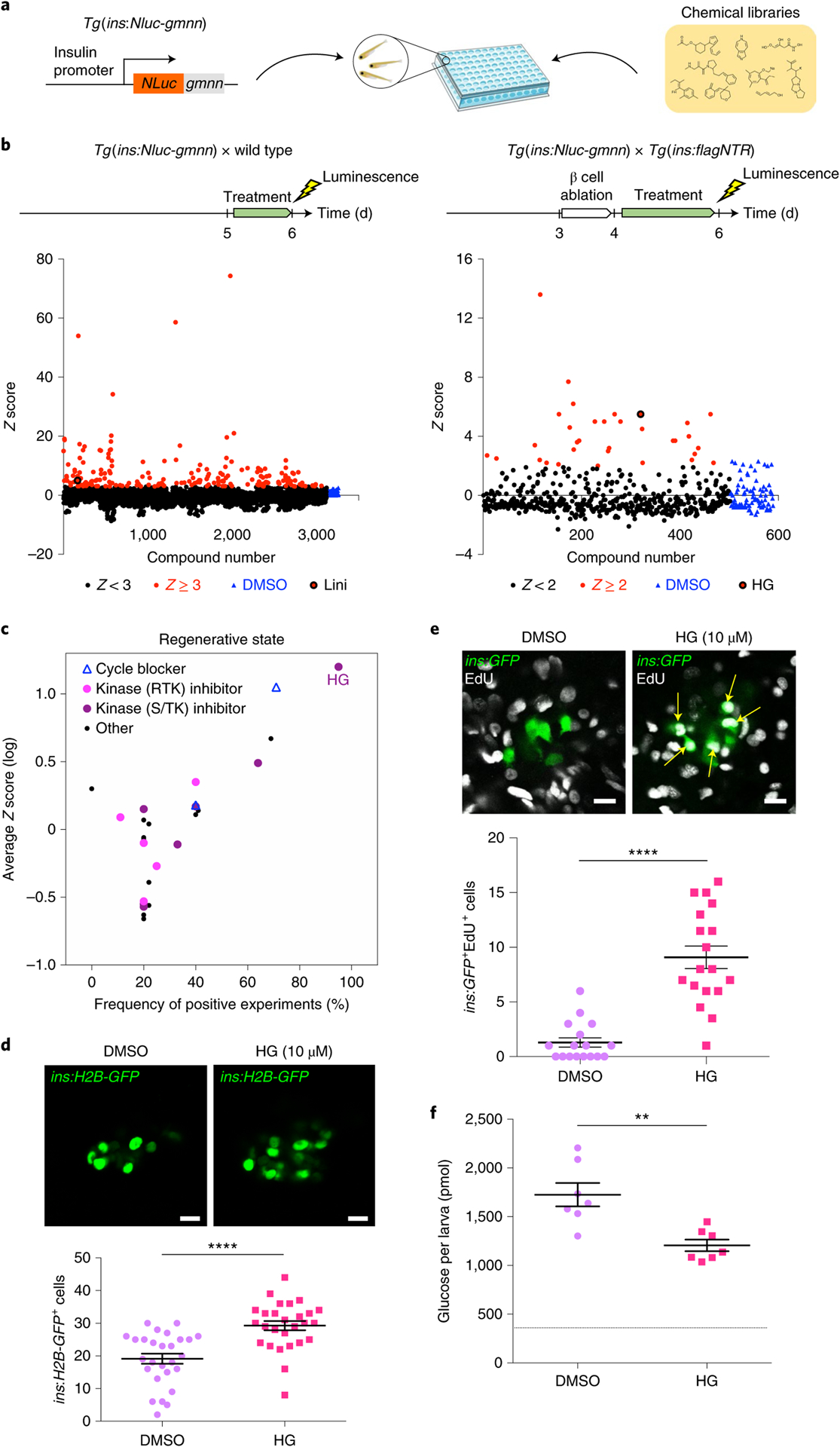
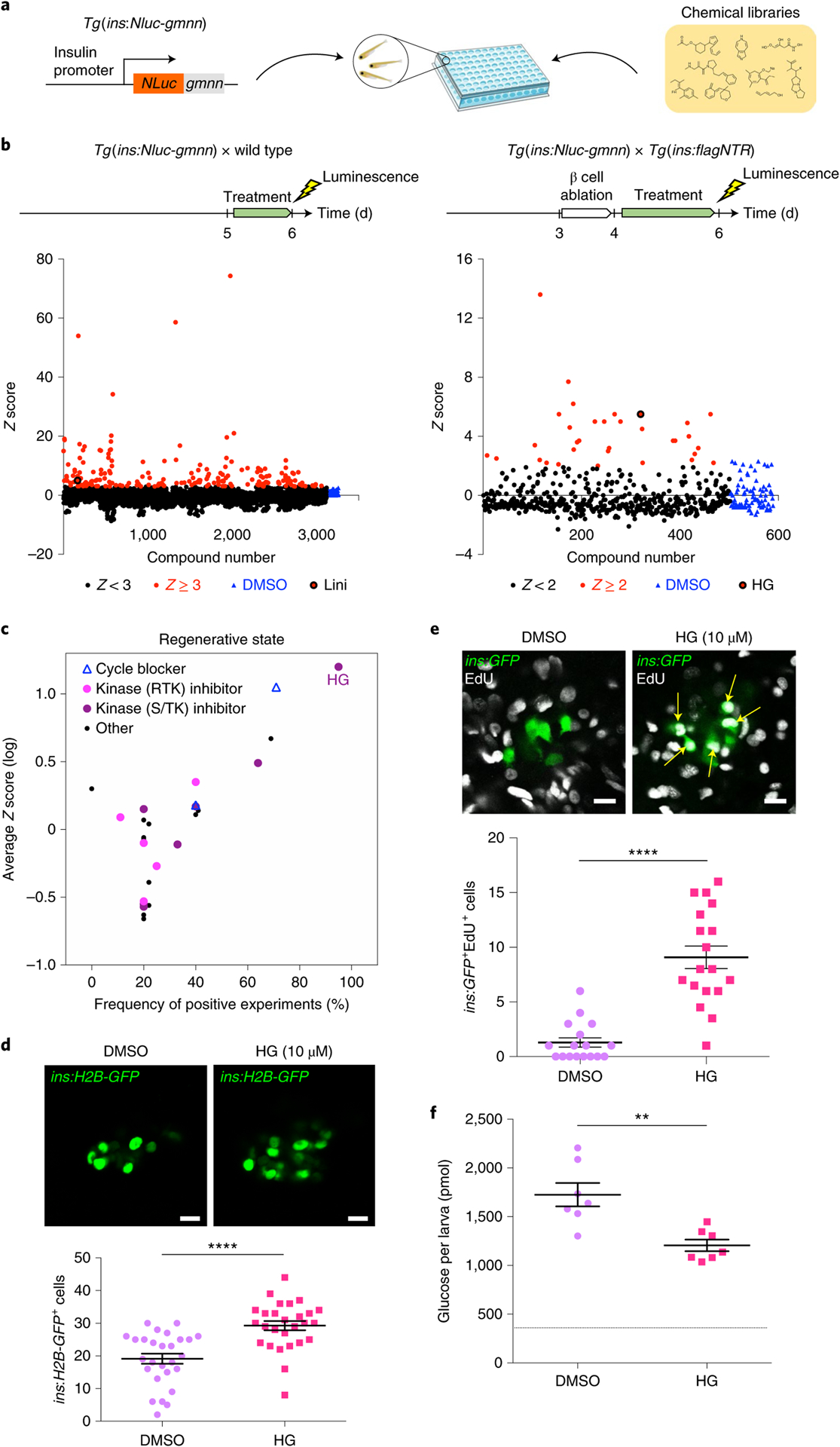
1.In vivo screen identifies a SIK inhibitor that induces β cell proliferation through a transient UPR. 2021, Nature Metabolism, IF = 19.865.
在正常发育期间或者高糖条件下,β细胞增殖使β细胞数量增加,这一过程可能促进糖尿病的β细胞再生,降低血糖水平。
本研究通过斑马鱼体内实验,高通量筛选能够促进β细胞增殖的潜在小分子,确定HG-9-91-01(HG)是β细胞再生过程中最有效的苗头化合物。
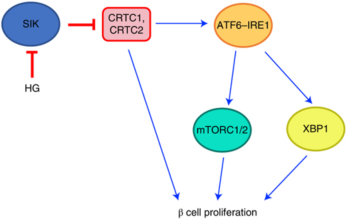
HG是盐诱导激酶(SIK)的抑制剂,主要作用靶点是SIK1。本研究在三个不同物种(斑马鱼,小鼠和人)的β细胞中,进一步证实特异性过表达SIK1可阻断HG对β细胞增殖的作用。小鼠β细胞的单细胞转录组分析也表明,HG诱导转录激活因子6(ATF6)依赖的未折叠蛋白反应(UPR),刺激β细胞增殖。机制研究表明,HG抑制SIK后,整合多个信号通路诱导β细胞增殖,包括ATF6-IRE1, CRTC1-CRTC2和mTOR。本研究证明HG可以激活UPR,利用UPR促进糖尿病中β细胞增殖。
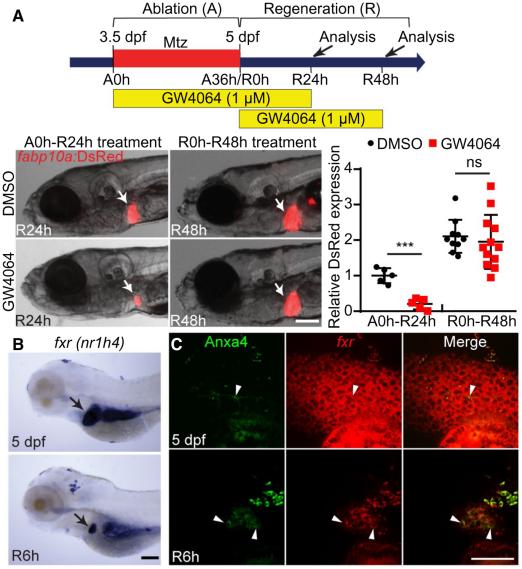
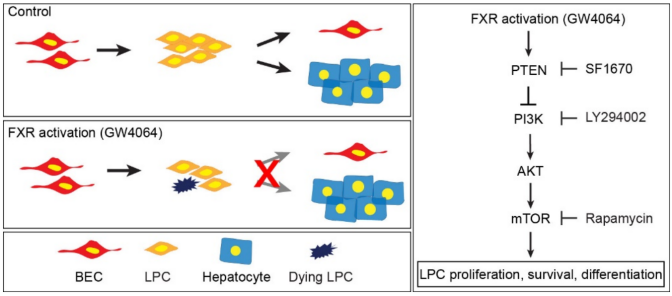
2.Farnesoid X Receptor Activation Impairs Liver Progenitor Cell-Mediated Liver Regeneration via the PTEN-PI3K-AKT-mTOR Axis in Zebrafish. 2021,Hepatology, IF = 17.298.
轻度肝损伤后,肝细胞发生复制,当肝细胞增殖受到抑制时,胆管上皮细胞(BECs)驱动肝再生来恢复肝脏质量和功能,可作为肝移植的替代方案,但BECs驱动肝再生的分子基础仍然未知。
本研究通过斑马鱼肝细胞消融模型进行化学筛选,确定法尼醇X受体(FXR)激动剂GW4064是BECs驱动肝再生的强效抑制剂。
BECs驱动肝再生包括三个过程:BECs向肝祖细胞(LPCs)去分化、LPCs向肝细胞分化、肝细胞增殖。本研究发现激活FXR阻断LPC向肝细胞分化,抑制LPC增殖并促进其死亡。分子机制研究证明,激活FXR可以增强PTEN(调节细胞周期)活性,而抑制PI3K-AKT-mTORC1(PTEN下游经典信号通路)活性可阻断BEC驱动的肝再生。
本研究确定了激活FXR对BECs驱动肝再生的有害影响,并证明了这种影响是由FXR-PTEN-PI3K-AKT-mTOR轴介导的。鉴于FXR激动剂对临床上多种肝脏疾病的有益作用,本研究的结果:FXR激活对LPCs有害,提示建议在临床中使用更个体化的激动剂。我们的研究结果,。
相关产品
产品留言

微信公众号